18F-fluciclovineは、血液脳関門を透過し1)、アミノ酸トランスポーターを介して細胞内に取り込まれますが2)、腫瘍細胞等では正常細胞よりもアミノ酸代謝が亢進していることから、正常細胞よりも腫瘍組織でより多く集積します。

ご利用にあたっての注意
「核医学(製品関連)FAQ」は、医療関係者の方を対象に、弊社製品をご使用いただく際の参考情報を提供することを目的としています。
ご使用者の判断と責任においてご活用いただき、その結果については責任を負いかねますので、あらかじめご了承ください。
製品のご使用にあたっては、最新の添付文書をご確認いただきますようお願いします。
本FAQを許可なく複写、複製、転掲、改変等を行うことはご遠慮ください。
製品についてご不明な点がございましたら、弊社製品お問い合わせ専用フリーダイヤル( 0120-076-941)にお問い合わせください。
0120-076-941)にお問い合わせください。
製品情報についてのお問い合わせ
- TEL:0120-076-941 受付時間:9:00~17:30(土・日・祝日・当社休業日を除く)
- FAX:03-5634-5173
- *お急ぎでない場合は、お問い合せフォームからご質問いただけます。
- *医療用医薬品をお取り扱いしておりますので、一般の方からのお問い合わせはお受けしておりません。お問い合わせは受診されている医療機関へお願いいたします。
- お問い合わせフォーム
![[別ウィンドウ]](/sites/default/images/corpo/common/img/icon/window-01.png)
2) J Nucl Med 52:822-829, 2011
健康成人を対象に本剤を静脈内投与したときの薬物動態を検討した結果、本剤はほとんど代謝を受けずに緩徐に尿中に排泄される腎・尿路排泄型の薬剤であることが示唆されました1)。
累積尿中放射能排泄率は経時的に増加し、投与直後から投与後24時間までの尿中放射能排泄率の平均値は5.40%ID※となりました1,2)。
※ID:投与量(Injection Dose)
2) アキュミン静注 添付文書(第1版), 2021
健康成人6名に本剤174.4~201.4MBqを単回静脈内投与したとき、18F-fluciclovineの血中及び血漿中放射能分布率の平均値は、投与後2分でそれぞれ7.68%ID及び6.71%IDを示した後、経時的に減少し、投与後240分ではそれぞれ3.13%ID及び1.98%IDとなりました1,2)。
※ ID:投与量(Injected Dose)
2) アキュミン静注 社内資料:薬物動態(2021 年 3 月 23 日承認,CTD2.7.2.3.2)
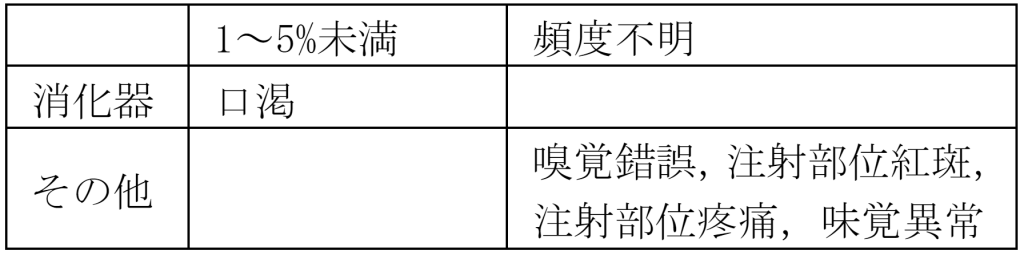
添付文書1)の「11. 副作用」(一部抜粋)及び「17. 臨床成績」(一部抜粋)には以下のように記載しています。
11.2 その他副作用
17.1 有効性及び安全性に関する試験
17.1.1 国内第Ⅲ相試験(NMK36-BT-P301試験)
副作用は1/20 例(5.0%)に認められ,口渇が1件であった。
国内外10試験*での副作用発現状況は以下のとおり2)。
【副作用発現状況一覧】
|
安全性評価対象例数 |
297例 |
|
副作用発現症例数 (%) |
11例 (3.7) |
|
副作用の種類 |
例数 (%) |
|
神経系障害 |
2 (0.7) |
|
頭痛 |
1 (0.3) |
|
嗅覚錯誤 |
1 (0.3) |
|
心臓障害 |
1 (0.3) |
|
心室性期外収縮 |
1 (0.3) |
|
一般・全身障害及び投与部位の状態 |
3 (1.0) |
|
口渇 |
1 (0.3) |
|
注射部位紅斑 |
2 (0.7) |
|
臨床検査 |
5 (1.7) |
|
白血球数増加 |
1 (0.3) |
|
尿中ブドウ糖陽性 |
1 (0.3) |
|
尿中蛋白陽性 |
1 (0.3) |
|
血中フィブリノゲン減少 |
1 (0.3) |
|
血中フィブリノゲン増加 |
1 (0.3) |
MedDRA/J version 24.0
*国内試験:第Ⅰ相試験(NMK36P1試験),第Ⅱ相試験(NMK36-BT-P201試験,NMK36-BT-P202試験,
NMK36-PC-P201試験,NMK36-PC-P202試験,NMK36-PC-P203試験),
第Ⅲ相試験(NMK36-BT-P301試験,NMK36-BT-P302試験)
海外試験:GE-148-001試験,BED008試験
なお、臨床検査値を評価した国内8試験、及び海外GE-148-001試験において、一部の臨床検査の測定項目に有意な上昇/低下が認められましたが、いずれも軽微であり、臨床的に重要な変化ではありませんでした3)。
2) アキュミン静注 インタビューフォーム(第2版), 2024
3) アキュミン静注 社内資料:臨床検査値の評価(2021年3月23日承認,CTD 2.7.4.3)
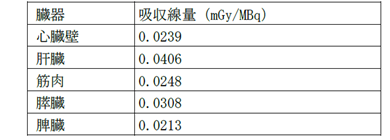
実効線量は0.0138mSv/MBqです1)。
MIRD法により算出した吸収線量は以下の通りです1)。